金黄色葡萄球菌是导致皮肤感染的常见病原体之一。随着抗生素的广泛应用,针对金黄色葡萄球菌的抗生素耐药已经是一个亟待解决的问题。因此迫切需要寻找一类不同于传统抗生素作用方式的新靶点,开展相关抗菌化合物的研究。ClpP是原核和真核生物中高度保守的ATP依赖的丝氨酸水解酶,负责调控蛋白质稳态。生理状态下,ClpP通过与伴侣蛋白例如ClpX形成ClpXP复合体发挥水解酪蛋白的功能。小分子激动金黄色葡萄球菌ClpP(SaClpP)异常降解关键蛋白质,是抗生素发现的新策略。由于异常激活人源ClpP (HsClpP)可引起线粒体蛋白稳态失调而产生细胞毒性,因此理想的靶向性激动SaClpP的抗生素研究必须充分避免对线粒体HsClpP产生干扰。然而目前尚未见选择性的SaClpP激动剂被报道。
国科大杭州高等研究院药物科学与技术学院(以下简称杭高院药学院)杨财广首席教授研究团队在金黄色葡萄球菌ClpP激动剂抗耐药菌感染方面取得新进展,相关成果以“Anti-infective therapy using species-specific activators of Staphylococcus aureus ClpP”为题,在线发表于Nature Communications(IF=17.694)期刊。

本研究利用高通量筛选发现Wnt信号通路抑制剂ICG-001可激动两种ClpP的酶活。对ICG-001结构优化之后,实现了一类新骨架ClpP激动剂ZG111通过引起线粒体蛋白稳态失调抗胰腺癌(Cell Chem Biol, 2022, 29, 1396)。在构效关系研究基础上,获得ZG111的衍生物ZG180,对两种ClpP的激动活性均显著提高。对ZG180结合SaClpP与HsClpP的复合物晶体解析,以及SaClpP与HsClpP蛋白序列对比分析,发现ZG180在SaClpP蛋白结合口袋处的91位异亮氨酸与HsClpP的同源位置146位色氨酸在空间上具有较大差异。基于结构差异开展设计,在ZG180中引入手性的甲基取代,得到(R)-和(S)-ZG197。生化实验表明其可以选择性结合并激动SaClpP,而对HsClpP无明显激动活性。基于这个差异位点,研究者尝试解释其选择性的作用机制。将SaClpP中的关键I91突变为色氨酸后,(S)-ZG197与该I91W突变体的作用减弱。而针对HsClpP的W146A突变提高了(R)-ZG197的活性。同时,研究者也发现HsClpP中存在一个较长的C末端基序,而这个序列在SaClpP及其他原核生物的ClpP中缺失。将该C端基序截短后,(R)-ZG197对HsClpP的活性提高,而C末端截短的HsClpPW146A突变体可以使(R)-和(S)-ZG197活性进一步增强,这些结果解释了两个化合物实现选择性的作用机制。
后续研究者在细菌水平上评价了两个化合物的抗菌效果。(R)-和(S)-ZG197可以有效抑制临床多药耐药菌;同时体外杀菌实验也证实(R)-和(S)-ZG197可以在6 h内有效清除病原菌;与传统抗生素利福平等联用可以杀死造成慢性感染的持留菌。最后在斑马鱼和小鼠动物模型上,发现(R)-和(S)-ZG197对耐甲氧西林金黄色葡萄球菌(MRSA)感染斑马鱼有显著的治疗作用,且在小鼠皮肤感染模型上可以显著降低皮肤表面的细菌载量,从而有效抑制MRSA感染。
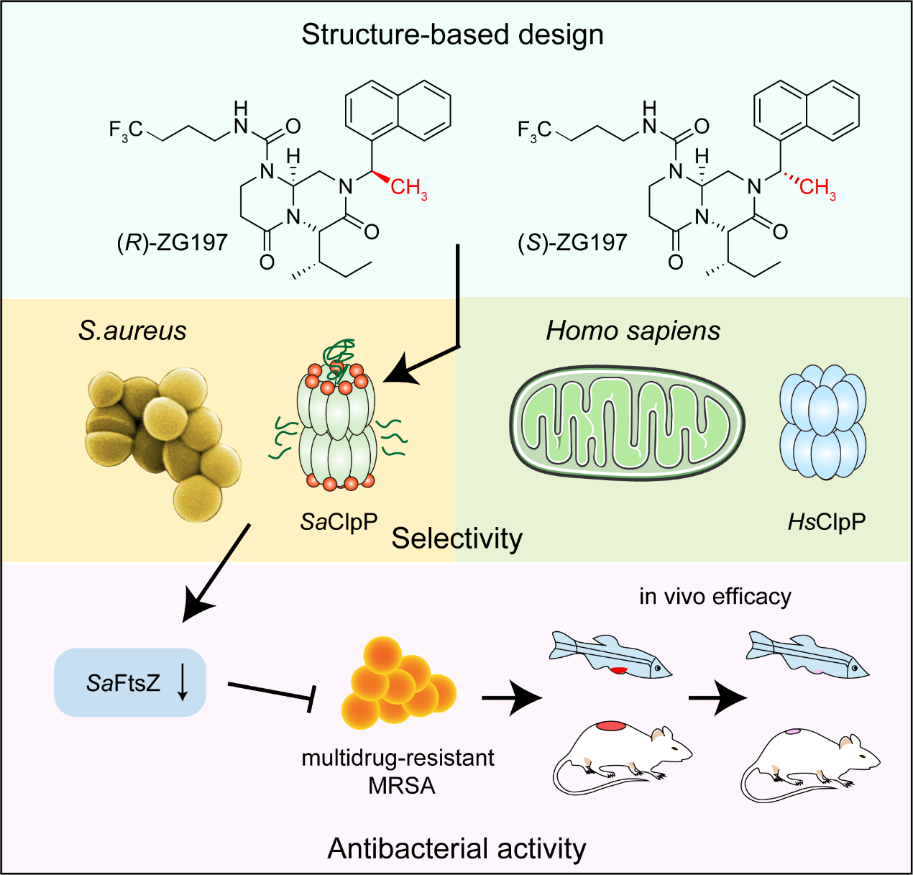
图1 小分子选择性激动金黄色葡萄球菌ClpP抗耐药菌感染
该研究获得两个选择性作用于SaClpP而不影响HsClpP的小分子激动剂,并揭示了实现选择性作用的机制,从概念上验证了针对两种种属同源性较强的ClpP蛋白可以实现选择性激活。此外,这项工作有可能为治疗MRSA感染提供有前景的策略,并推动针对新靶点抗生素药物发现研究。
该论文的共同第一作者为国科大杭高院药学院博士研究生魏柄妍(国科大杭高院为第一署名单位)、上海药物研究所副研究员张涛博士,以及国科大杭高院药学院博士后王蓬宇博士,通讯作者为国科大杭高院药学院杨财广首席教授。该研究得到上海科技大学季泉江课题组,同济大学附属东方医院吴文娟课题组,上海药物研究所蓝乐夫课题组,复旦大学甘建华课题组,上海同步辐射光源,上海公共卫生临床中心,上海药物研究所先导专项化合物资源库的支持,并获得国家自然科学基金的资助。
原文链接:https://www.nature.com/articles/s41467-022-34753-0
 国科大杭高院药学院
国科大杭高院药学院