2023年6月12日,国科大杭州高等研究院(以下简称杭高院)周斌课题组与复旦大学医学分子病毒学教育部/卫健委/医科院重点实验室陆路课题组合作研究成果“An inducible hACE2 transgenic mouse model recapitulates SARS-CoV-2 infection and pathogenesis in vivo”以“Research Article”形式在线发表于国际知名学术期刊《美国国家科学院院刊》(简称PNAS)。作为四大知名期刊(Cell,Nature,Science,PNAS)之一的PNAS创刊于1914年,拥有超过百年的办刊历史,是国际基础科学领域的知名学术期刊。
该研究利用Cre-loxP遗传谱系示踪技术与人源化hACE2结合,创建了一种诱导型hACE2小鼠模型,结合细胞特异性Cre工具小鼠可实现在靶细胞中特异性表达hACE2蛋白并同时对靶细胞进行遗传示踪。此诱导型hACE2小鼠模型不仅适用于对SARS-CoV-2药物筛选和疫苗评价,还可应用于SARS-CoV-2感染相关的细胞机制和遗传学研究,助力新冠病毒感染相关研究。

新型冠状病毒感染(COVID-19)是由严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)引起的急性呼吸道传染病。尽管目前我们步入后疫情时代,但疫情并未完全消失。病毒变异具有随机性,因此构建适用于SARS-CoV-2等可利用ACE2受体感染的各类冠状病毒(包括SARS-CoV及SARS相关冠状病毒、HCoV-NL63等)研究的小鼠模型对于研究SARS-CoV-2等致病机理并测试新型治疗方案具有重要意义。
SARS-CoV-2可通过识别人体细胞表面的血管紧张素转换酶2(hACE2)进入人体细胞。人体中多种组织脏器表达hACE2,例如上呼吸道、肺脏、心脏、肝脏、肾脏、肠道和大脑等等,因此这些器官都会被SARS-CoV-2识别并攻击 [1, 2]。肺部是SARS-CoV-2攻击的首要目标。人类肺脏中多种上皮细胞类型表达hACE2,其中AT2细胞主要负责肺泡上皮受损后的再生修复,人体AT2细胞高表达hACE2,是SARS-CoV-2在肺部的重要攻击对象之一。
人源化小鼠是研究人类疾病的重要模型,研究发现小鼠细胞血管紧张素转换酶2(mACE2)不易于被SARS-CoV-2识别,因此构建的人源化hACE2新冠小鼠感染模型被广泛应用于新冠病毒感染相关研究 [4]。目前已报道多种人源化hACE2转基因模型小鼠,这些hACE2的表达受Krt8,HFH4,CAG或mACE2启动子驱动。然而Krt8在肺脏主要表达在支气管管腔上皮细胞,HFH4主要表达在支气管ciliated细胞,CAG为广谱型启动子在所有细胞类型表达。在本研究中,研究人员构建了mACE2-2A-CreER;R26-tdTomato工具小鼠并揭示在小鼠肺脏中mACE2主要表达支气管club细胞中。因此,基于上述启动子构建的hACE2转基因工具均无法完全模拟人体内hACE2的表达谱,特别是对AT2细胞的靶向。
为了解决这一问题,研究人员将CAG-loxp-stop-loxp-hACE2-IRES-tdTomato序列插入到Rosa26基因位点,构建了一种可诱导型hACE2转基因模型小鼠,简称为R26-hACE2-tdT。R26-hACE2-tdT的工作原理为,当发生Cre-loxP重组,Cre+细胞会同时表达hACE2和tdTomato蛋白,由于这种同源重组发生在DNA水平,所以Cre+细胞及其所有子代细胞均会永久性表达hACE2并被标记为tdTomato。针对以上提到的已有hACE2工具细胞靶向的不足,R26-hACE2-tdT可以结合细胞特异性表达Cre的工具小鼠,实现细胞特异性及高效性靶向标记,以精确模拟和应用于SARS-CoV-2攻击人体细胞的病理研究。
综上,本研究基于Cre-loxP技术成功构建了可诱导型人源化hACE2小鼠模型,可搭配细胞特异性Cre遗传工具,不仅适用于对靶细胞特异性SARS-CoV-2感染研究、药物筛选、疫苗评价,还可应用于感染后组织再生修复的遗传学等研究。
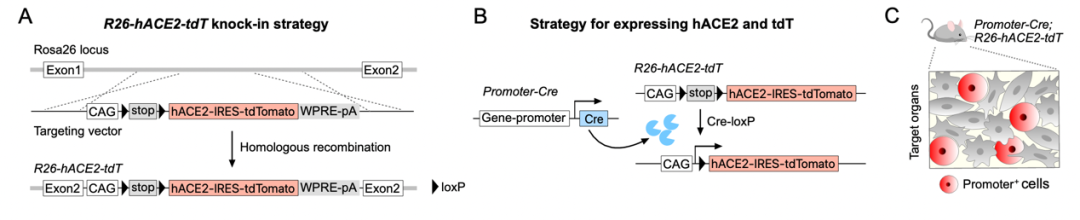
诱导型hACE2转基因小鼠模型的构建及应用策略
(A)R26-hACE2-tdT构建策略。(B,C)结合细胞特异性Cre工具,可实现在靶细胞中特异性表达hACE2并被永久性遗传标记。
杭高院为第一完成单位。杭高院周斌课题组副研究员刘扩,中国科学院分子细胞科学卓越创新中心博士研究生唐慕雪,复旦大学青年副研究员徐巍为该论文共同第一作者。杭高院周斌研究员和复旦大学医学分子病毒学教育部/卫健委/医科院重点实验室陆路研究员为该论文共同通讯作者。该工作得到中国科学院、基金委、科技部、上海市科委、杭高院等经费支持。
主要参考文献
[1].C. Muus et al., Single-cell meta-analysis of SARS-CoV-2 entry genes across tissues and demographics. Nat Med 27, 546-559 (2021).
[2].X. Zou et al., Single-cell RNA-seq data analysis on the receptor ACE2 expression reveals the potential risk of different human organs vulnerable to 2019-nCoV infection. Front Med-Prc 14, 185-192 (2020).
[3]. C. G. K. Ziegler et al., SARS-CoV-2 Receptor ACE2 Is an Interferon-Stimulated Gene in Human Airway Epithelial Cells and Is Detected in Specific Cell Subsets across Tissues. Cell 181, 1016-+ (2020).
[4].M. M. DeGrace et al., Defining the risk of SARS-CoV-2 variants on immune protection. Nature 10.1038/s41586-022-04690-5 (2022).

